一般的な Taq ポリメラーゼを用いた PCR の場合、PCR産物には3‘末端にA(アデニン)が付加された3’末端が突出した形の二本鎖 DNA が形成される。この PCR 産物をベクターにクローニングする場合、この3‘末端に A が突出している性質を利用してクローニング(ライゲーション)すうのが簡単である。A と相補的な T (チミン)が突出したベクターが市販(プロメガ社・タカラ社など)されている。(一般的に TA ベクターと呼ばれる)
これを用いて、精製した PCR 産物をライゲース(DNA 結合酵素)を用いて、ベクターと連結させる。一般に TA クローニングと呼ばれる手法である。
* Proof-Reading 活性のあるポリメラーゼによるPCR産物は3‘末端にAが付加されていないので TA クローニングが使えないので、他の方法を用いる必要がある。
プロメガ社のライゲースを用いると3マイクロ・リットルの精製PCR産物を1時間の室温での反応でベクターに組み込める。

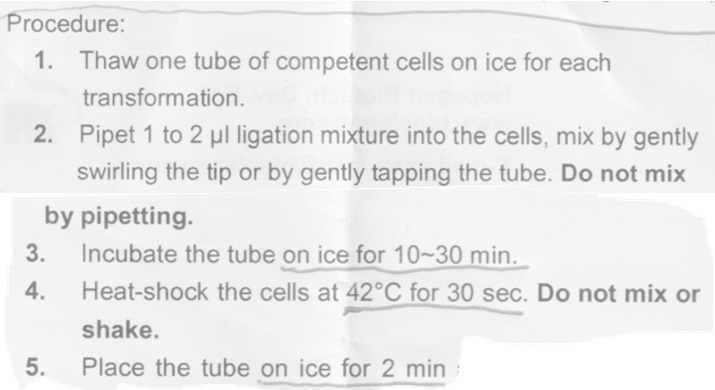
ベクターをバクテリア内に導入する(トランスフォーメーション)には、ライゲースの反応液を、直接、高効率コンピテント・セルにトランスフォームするのが簡便で良い。(コンピテント・セルの総量の10分の1以下の量のライゲーション反応液を用いるのが望ましい。25
マイクロのコンピテント・セルに対して1-2マイクロ・リットルのライゲーション液が良い)
25マイクロのバクテリア液(コンピテント・セル)と2マイクロのライゲーション反応液を混ぜて、10分間、氷上で反応させ、42度で30秒間反応させる(Heat-shock)、その後2分間氷上で保存する。
直ぐに、全量を、直接 Xギャル(30マイクロ・リットル)を塗布した、アンピシリンを含む10㎝径 LB アガープレートに撒いて、37度で一晩培養すると、PCR産物が挿入されたプラスミドを持つ白いコロニーが認められる(PCR産物の挿入されていないプラスミドを持つコロニーは青色)。白いコロニーをピペット・チップの先端で拾い上げ、アンピシリンを含む LB液体培養液2mlに接種して、一晩、37度で振盪培養する。
プラスミドを抽出して、目的のPCR産物が挿入されているかどうか、PCR法・電気泳動法・DNAシークエンス法などで確認する。
*アンピシリンの耐性遺伝子用いたセレクションの場合は、この方法で良いが、他の抗生剤(カナマイシンなど)でセレクションをする場合は、この方法では全てのクローンが死滅してしまうので、用いてはならない。他の抗生剤によるセレクションの場合は、常法の通り、SOC 溶液で振盪培養した後に、抗生剤を含むLBプレートに塗布する必要がある。

